010-51282213
北京赛百奥科技有限公司
北京市海淀区亮甲店130号华玉大厦505室
989203@qq.com
Lonza重组C因子法内毒素检测解决方案
近日,受国家政策变动影响,内毒素检测试剂所用原料鲎(中国鲎及圆尾鲎)被列为国家二级保护动物(国家林业和草原局、农业农村部2021年2月25日公告(2021年第3号)),意味着内毒素检测试剂原料将受到严格管控,鲎试剂生产厂家宣称将停止供应以下产品:
1、单支凝胶法鲎试剂 (0.1mL) - 灵敏度0.5、0.25、0.125、0.06 EU/mL将于今年 6月30日停产;
2、四次装凝胶法鲎试剂 (0.5mL) - 灵敏度0.25、0.125EU/mL将于今年 12月31日停产。
根据公告以及LAL厂家的官宣,国内药品、医疗器械放行将面临困境,药企、医疗器械企业须尽早选择其他替代测试方法。目前药典收录方法都是以鲎试剂为基础制定,新方法只能寄希望于找到LAL替代方法。
LAL替代品研究进展
说到寻找鲎试剂(LAL试剂)的替代品,这其实在国内外一直是个热点话题。内毒素的控制在医疗、药品的研究中应用非常广泛,传统的鲎试剂法中涉及使用到远古生物鲎血液中的变形细胞,由于生态环境的恶化,鲎数量大规模减少,相关研究人员不断地研究开发内毒素的新方法以应对不同的检测需求。


鲎采血现场
图片来源:Timothy Fadek/Corbis/Getty
磁弹性传感器测定法:该方法使用应激反应磁弹性传感器,监测 LAL测定的凝胶形成(黏度变化)进而测定内毒素的总量[1]。在与不同内毒素浓度的测试样品混合后,将带状磁弹性传感器(12.7mm×6mm×28μm)浸入LAL 测定中,并记录传感器的共振幅度随时间的变化。实验结果表明内毒素浓度与最大凝血率之间存在极好的相关性。磁弹性传感器的技术可以在需要大约 20 min 的测试中检测到0.0105EU/mL的内毒素。与用于确定内毒素浓度的光学方法不同,测试溶液的颜色不影响磁弹性传感器测量。由于传感器读取器电子器件的尺寸小且成本低,基于磁弹性传感器的内毒素检测系统非常适合广泛用于内毒素的测定。该方法按照原理可适用于所有采用 LAL 法测定的放射性药品中。
生物传感器:以鲎试剂的替代品为核心的研究,包括大量生物传感器的研究[2]。针对细菌内毒素快速、实时、灵敏的检测,生物传感器法是未来内毒素检测发展趋势之一。内毒素表面能够通过静电和疏水性物质与适当修饰的表面相互作用,通过磷酸基团的配位,或更有选择性地与识别的蛋白质或适体结合。根据这个原理相关的生物传感器可以分为蛋白类、肽类、抗体类、适体类、细胞类等,而这些检测方法中,重组C因子法无疑是比较流行的一种方法。
近年来,重组C因子法也是使用由圆尾鲎或东方鲎的基因克隆而制成的重组C 因子与内毒素反应,以终点法定量测定荧光底物的单步酶促反应裂解产物来量化细菌内毒素的一种方法[3]。国内已有相关的研究报道[4]。欧洲药典委员会
分化抗原簇蛋白 14(CD14)[5]、Toll 样受体4(TLR4)和髓样分化蛋白-2(MD-2)[6]、刀豆素A[7]、重组的抗鲎LPS因子[8-10]、CramoLL lectin[11]等蛋白应用于内毒素的检测也取得了一定的成果,其中TLR4和MD-2为识别传感器的电化学检测方法可以检测到0.000 5~5EU/mL的内毒素,刀豆素A 为识别传感器的光学检测方法检测内毒素的范围在0.2~20 μg/mL。重组的抗鲎LPS因子为识别蛋白,检测灵敏度可达100pg/mL。
lonza重组表达的C因子内毒素检测方法
成熟的重组C因子法内毒素检测技术:
Lonza PyroGeneTM重组C因子试剂盒是内毒素检测方法的发展成果。通过体外重组鲎凝血级联反应的第一个组分:C因子,重组C因子法只需一部反应,优于传统LAL法且不依赖动物源成分-鲎血。
PyroGeneTM重组C因子法,激活的C因子直接剪切一个荧光底物,产生的信号被荧光酶标仪识别。由于荧光信号的动态范围大,相较于传统的动态LAL法,PyroGeneTM重组C因子法只需一步反应,检测范围即可达到5.0EU/ml–0.005EU/ml。
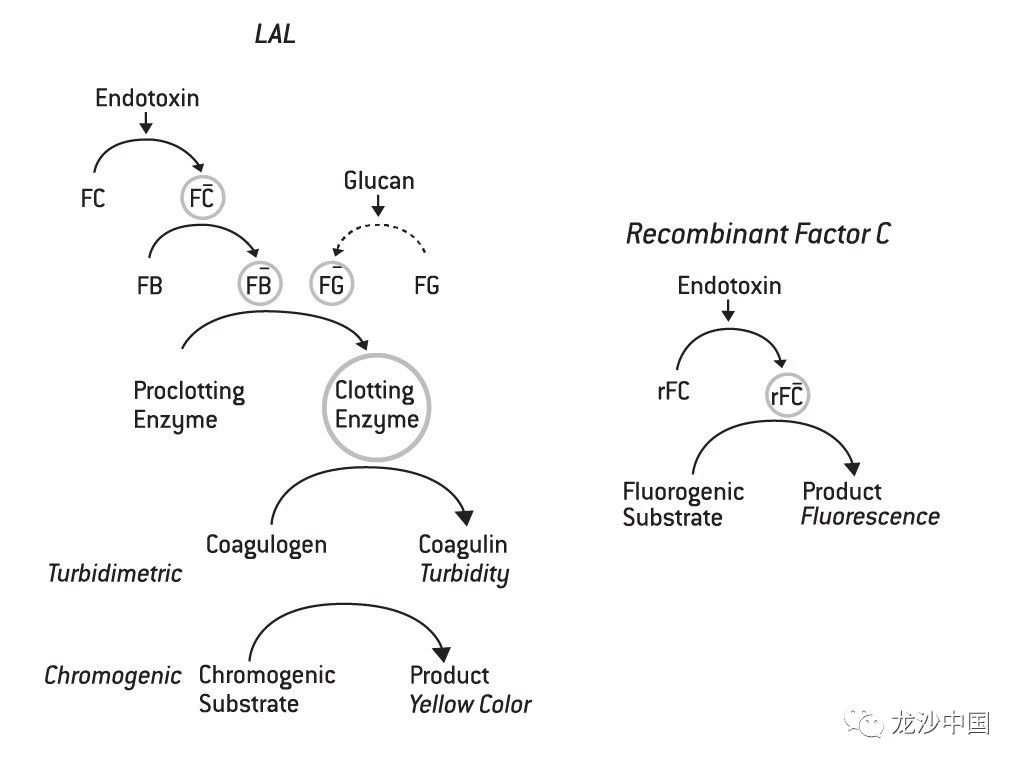
上图分别展示了PyroGeneTM重组C因子与传统LAL法,如动态显色法和动态浊度法的激酶级联反应。
合规审批历史
2012年6月,FDA将重组C因子法纳入可替代方法;
2015年7月,欧洲药典将重组C因子法纳入可替代方法;
2018年9月,FDA批准了首个以重组C因子检测内毒素的单抗药;
2018年12月,欧洲药典征求意见稿将重组C因子纳入欧洲药典;
2019年1月,中国药典征求意见稿将重组C因子纳入2020版中国药典- 2020版药典已纳入,作为可替代方案;
2019年12月,欧洲药典将重组C因子纳入到新一版的欧洲药典中,预计2021年生效。
* 依据美国药典(USP) <1225>和人用药品注册技术要求国际协调会议(ICH)Q2B,重组C因子法只是被视为“替代检测方法”。这意味着监管机构只会认可做过验证研究的重组C因子检测结果,并且必须对使用该方法检测的每个产品进行验证研究。(验证研究通常是用来比较替代方法和药典方法,验证两者之间的相关性。经过验证之后,跟进药物或器械的监管备案是必要的)。
Lonza rFC 产品
产品名称 | 灵敏度 EU/mL | 检测 | 货号 |
PyroGene™ Recombinant Factor C Assay | 0.005 to 5 | 192tests/kit | 50-658U |
PyroGene™ Recombinant Factor C Assay | 0.005 to 5 | 2880tests/kit | 50-658NV |
PyroWave™ XM Fluorescence Reader | 25-345S | ||
WinKQCL™ 6 Software Package | 25-611 |
重组C因子是一种化学合成的试剂,性状更稳定,均一性相对也更好。试剂价格目前和鲎试剂相当,后期如在国内外广泛应用起来,价格会比鲎试剂更具竞争优势。
产品订购请点击:
参考文献:
[1]:Ong K G, Leland J M, Zeng K, et al. A rapid highly-sensitive endotoxin detection system [J]. Biosens Bioelectron, 2006, 21(12): 2270-2274.
[2]:Su W, Ding X. Methods of Endotoxin Detection [J]. J Lab Autom. 2015, 20(4): 354-364.
[3]: 裴宇盛,蔡彤,高华.细菌内毒素检查新方法进展 [J].药物分析杂志, 2014, 34(3): 392-395.
[4]:裴宇盛,蔡彤,陈晨,等.重组 C因子法检测福沙匹坦二葡甲胺中细菌内毒素的方法学研究 [J].中国现代应用药学, 2019, 36(1): 1-4.
[5]:Burkhardt M, LopezAcosta A, Reiter K, et al. Purification of soluble CD14 fusion proteins and use in an electrochemiluminescent assay for lipopolysaccharide binding [J]. Protein Expression Purif, 2007, 51(1): 96-101
[6]:Yeo T Y, Choi J S, Lee B K, et al. Electrochemical endotoxin sensors based on TLR4/MD-2 complexes immobilized on gold electrodes [J]. Biosens Bioelectron, 2011, 28(1): 139-145.
[7]:Hreniak A, Maruszewski K, Rybka J, et al. A luminescence endotoxin biosensor prepared by the sol-gel method [J]. Opt Mater (Amsterdam, Neth) 2004, 26(2): 141-144.
[8]: Pallarola D, Battaglini F. Surfactant-assisted lipopolysaccharide conjugation employing a cyanopyridinium agent and its application to a competitive assay [J]. Anal Chem, 2009, 81(10): 3824-3829.
[9]:Priano G, Pallarola D, Battaglini F. Endotoxin detection in a competitive electrochemical assay: synthesis of a suitable endotoxin conjugate [J]. Anal Biochem, 2007, 362(1): 108-116.
[10]:Priano G, Battaglini F. Use of an antimicrobial protein for endotoxin detection in a competitive electrochemical assay [J]. Anal Chem, 2005, 77(15): 4976-4984.
[11]:Oliveira M D L, Andrade C A, Correia M T, et al. Impedimetric biosensor based on self-assembled hybrid cystein-gold nanoparticles and CramoLL lectin for bacterial lipopolysaccharide recognition [J]. J Colloid Interface Sci, 2011, 362(1): 194-201.